Symptome
Gutartige Geschwülste des Darmes (Polypen) machen keine Symptome – abgesehen von einer gewissen Blutungsneigung und Stuhlunregelmäßigkeiten bei sehr großen Polypen.
Hintergrundwissen
Über die Lebenszeit gesehen besteht in Deutschland für jeden Menschen ein Risiko von ca. 7 % an Darmkrebs zu erkranken. Männer sind etwas häufiger betroffen als Frauen und erkranken früher. Etwa ein Viertel der Fälle kommen familiär gehäuft vor, weshalb Familienangehörigen von Polypen- oder Darmkrebspatienten üblicher Weise dringend zur Darmspiegelung geraten wird. Wenn alle Menschen das Vorsorgeangebot nutzen würden, könnte Darmkrebs fast vollständig vermieden werden. Das Vorsorgeangebot beinhaltet Blutstuhl-Teste ab dem 50. und Vorsorge-Koloskopie ab dem 55. Lebensjahr, seit 2018 für Männer ab dem 50. Lebensjahr. Familiär Betroffene sollten spätestens 10 Jahre vor dem Erkrankungsalter des betroffenen Angehörigen zur Vorsorge. Das Ziel dieser Vorsorge ist es, gutartigen Vorstufen von Darmkrebs (Polypen) zu erkennen und zu entfernen, lange bevor aus ihnen Krebs entstehen kann.
Man unterscheidet „unechte“, meist hyperplastische Polypen ohne Entartungstendenz (ca. 1/5 der Fälle) von echten Polypen, sog. Adenomen, die über einen größeren Zeitraum – vermutlich 10 bis 15 Jahre – in ein Karzinom übergehen können („bösartiger Polyp“; Adenom-Karzinom-Sequenz). Dieser sehr lange Zeitraum kann genutzt werden, um die (noch) gutartigen Befunde zu erkennen, endoskopisch zu entfernen und auf diese Weise das Kolonkarzinom zu vermeiden (Primärprophylaxe).
Diagnostik
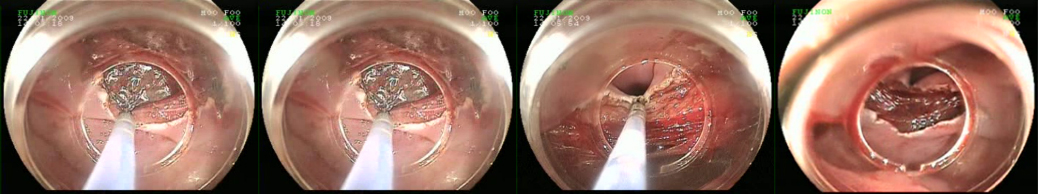
Die „Vorsorgekoloskopie“, also Untersuchung von beschwerdefreien Menschen, ist eine Domäne der ambulanten Medizin. Nach guter Darmvorbereitung und mit Hilfe moderner Endoskope und einer elektronisch zuschaltbaren Bild-/und Farb-Modifikation (Chromo-Endoskopie) gelingt es in über 95 % der Fälle einen Polypen korrekt als gutartig oder bösartig zu klassifizieren. Fast alle Polypen, die entdeckt werden, können im gleichen Untersuchungsgang auch entfernt werden, entweder durch Zangenentfernung von sog. Polypenknospen oder durch Polypektomie mit einer Schlinge. Da das Komplikationsrisiko der Polypen-Entfernung mit Größe, Form und Lage des Polypen ansteigt, unterscheidet man vereinfacht normale Polypen von Problempolypen. Meistens werden Patienten mit Problempolypen zur Entfernung in ein Krankenhaus eingewiesen und verbleiben die Nacht nach dem Eingriff sicherheitshalber dort, wo im Komplikationsfall eine rund um die Uhr Versorgung gewährleistet ist.
Befund
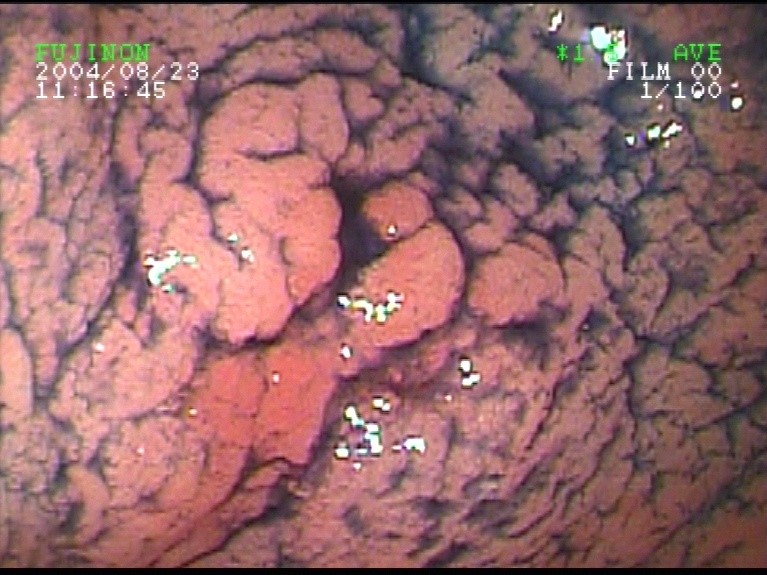
Bildbeispiele von Polypenknospe, kleiner flacher Polyp, kleiner gestielter Polyp, Problempolypen (flach und gestielt).
Therapie von Problempolypen – Das Speyerer Modell
Die Therapie von Problempolypen setzt einen gut gereinigten Darm voraus. Es wird immerhin eine innere Wunde erzeugt und das Ziel ist eine vollständige Entfernung sowie das vollständige Bergen aller Polypenanteile, die abgetragen werden, zur nachfolgenden pathologischen Begutachtung. Im Fall von Komplikationen (z.B. Blutung) muss ggf. zur Blutstillung nochmals endoskopiert werden können, weshalb der Patient meist auch nach dem Eingriff bis zum nächsten Morgen nüchtern bleiben muss.
Auch wenn mit den gängigen Darmvorbereitungslösungen durchschnittlich gute Sicherverhältnisse geschaffen werden können, ist die Wirksamkeit nicht bei allen Menschen gleich gut. Gelegentlich muss noch einmal nachgereinigt werden, was im Zweifelsfall mit einem sog. Endo-Washer auch über das Endoskop erledigt werden kann.
Die Darmvorbereitung ist für den Betroffenen meist lästiger und unangenehmer als die Untersuchung selbst, die ja Dank einer Sedierung mit Propofol völlig beschwerdefrei verschlafen wird. Deswegen wird in Speyer und Umgebung angeboten, dass Patienten mit Problempolypen sofort nach der Diagnosestellung beim niedergelassenen Arzt im Diakonissen-Stiftungs-Krankenhaus Speyer aufgenommen werden können und die Polypenabtragung noch am selben Tag erfolgt. Das erspart dem Patienten die Terminvereinbarung, die Wartezeit und ein nochmaliges Abführen.
Im Gegenzug wollen wir vermeiden, ambulante diagnostische Koloskopien ohne Problempolypen im Krankenhaus durchzuführen. Diese Untersuchungen können in einer der vielen Praxen der Region sehr gut und ohne nennenswerte Wartezeit abgebildet werden.
Ergebnisse
Die Koloskopie zeichnet sich durch eine technische Erfolgsrate zwischen 98 und 99 Prozent aus. Abhängig von Darmreinigung, anatomischen Besonderheiten und Sorgfalt der Untersuchung geht man von einer diagnostischen Genauigkeit von deutlich über 95 % aus. Damit ist die Koloskopie die genaueste Untersuchungsmethode für den Dickdarm und bietet im Vergleich zu möglichen Alternativen (z.B. MRT und CT) alle Behandlungsmöglichkeiten im selben Untersuchungsgang.
Die Polypektomie von gestielten Polypen und die endoskopische Resektion von flachen Polypen weist eine Erfolgsrate von 95 bis 99 Prozent auf. Im Fall großflächiger Polypen (> 20 mm, rasenförmig) kann ein solcher Polyp technisch nicht in einem Stück entfernt werden, es erfolgt eine sog. piece-meal-Resektion. Um sicher zu gehen, dass an den Abtragungsrändern nicht kleinste Polypenreste verbleiben und nachwachsen muss in solchen Fällen eine zeitnahe Kontrolle erfolgen (z.B. 3-12 Monate). In allen anderen Fällen erfolgt eine Kontrolle abhängig von Lage, Größe, Form, Histologie und Anzahl nach einem bis 5 Jahren. Alle Patienten bekommen nach dem Eingriff persönlich mitgeteilt, wann ihr individueller Kontrollzeitpunkt ist. Darüber hinaus wird mitgeteilt, ob die Kontrolle bei einem niedergelassenen Kollegen oder wegen erhöhter Wahrscheinlichkeit einer weiteren Therapie vielleicht doch besser im Krankenhaus durchgeführt werden sollte.
In seltenen Fällen befindet sich in einem abgetragenen Polypen schon bösartige Anteile (Karzinom). Durch eine sehr genaue Aufarbeitung des Gewebes in der Pathologie ist es möglich festzulegen, ob eine sog. „low-risk-Situation“ besteht – in diesem Fall gilt die endoskopische Resektion als Heilung und es muss nicht nachoperiert werden. In der „high-risk-Situation“ muss wegen einer möglichen Lymph- und Gefäß-Ausbreitung onkologisch nachoperiert werden (Dickdarm-Teilentfernung mit lokaler Lymphknoten-Entfernung). Die abschließende Empfehlung für den Patienten wird immer erst nach Diskussion des Falles im sog. Tumorboard des Darmzentrums abgegeben. In beiden Fällen ist die Prognose für den Patienten sehr gut, es besteht die Chance auf eine uneingeschränkte Lebenserwartung.
Die Komplikationsrate der diagnostischen Koloskopie beträgt 1-2 Promille. Die Entfernung einfacher Polypen (gestielte Form bis 20 mm, flache Form bis 10 mm) ist mit einem Risiko von 1-2 Prozent behaftet. Im Fall von Beschwerden sollte der Patient seinen Arzt kontaktieren oder ein Krankenhaus aufsuchen. Bei Problempolypen (> 20 mm Größe, Lage, Form, Anzahl) oder bei zwingend erforderlicher Blutverdünnung kann die Komplikationsrate auf 10 Prozent ansteigen. Immerhin ersetzt hier der endoskopische Eingriff eine Darmoperation. Üblicher Weise befinden sich solche Patienten in stationärer Obhut und werden professionell betreut – u.a. mit der Möglichkeit jederzeit eine endoskopische oder operative Therapie einzuleiten – und das Ganze nimmt in den allermeisten Fällen in einigen Tagen einen guten Ausgang.
Referenzen:
- T. Rabenstein. Vorlesung Differenzialdiagnose Innere Medizin – Reizdarmsyndrom, Obstipation und Meteorismus in Erlangen.
- T. Rabenstein. Basics und Gimmics bei der Koloskopie – Was hilft dem Praktiker? Fünftes Gastroenterologie-Seminar der Diakonissen Speyer-Mannheim am 23. Februar 2016 im Restaurant Philipp 1 in Speyer.
- T. Rabenstein. Vermeidung von Darmkrebs – was kann ich selber tun? Patienteninformation des Onkologischen Zentrums Speyer am Speyerer Gesundheitstag, 02. September 2015 in Speyer.
- Behrens A, Kreuzmayr A, Manner H, Koop H, Lorenz A, Schaefer C, Plauth M, Jetschmann JU, von Tirpitz C, Ewald M, Sackmann M, Renner W, Krüger M, Schwab D, Hoffmann W, Engelke O, Pech O, Kullmann F, Pampuch S, Lenfers B, Weickert U, Schilling D, Boehm S, Beckebaum S, Cicinnati V, Erckenbrecht JF, Dumoulin FL, Benz C, Rabenstein T, Haltern G, Balsliemke M, de Mas C, Kleber G, Pehl C, Vogt C, Kiesslich R, Fischbach W, Koop I, Kuehne J, Breidert M, Sass NL, May A, Friedrich C, Veitt R, Porschen R, Ellrichmann M, Arlt A, Schmitt W, Dollhopf M, Schmidbaur W, Dignass A, Schmitz V, Labenz J, Kaiser G, Krannich A, Barteska N, Ell C. Acute sedation-associated complications in GI endoscopy (ProSed 2 Study): results from the prospective multicentre electronic registry of sedation-associated complications. Gut. 2018 Jan 3. pii: gutjnl-2015-311037. doi: 10.1136/gutjnl-2015-311037. [Epub ahead of print]
- Behrens A, Ell C, et al (Studiengruppe ALGK-ProSed). Safety of sedation during gastroscopy and colonoscopy in low-risk patients - results of a retrospective subgroup analysis of a registry study including over 170 000 endoscopies. Z Gastroenterol. 2016; 54: 733-9.
- Hafner S, Zolk K, Radaelli F, Otte J, Rabenstein T, Zolk O. Water infusion versus air insufflation for colonoscopy. Cochrane Database Syst Rev. 2015 May 26; 5: CD009863.
- Rabenstein T, Radaelli F, Zolk O. Warm water infusion colonoscopy: a review and meta-analysis. Endoscopy 2012; 44: 940-51.
- Pohl J, Nguyen-Tat M, Pech O, May A, Rabenstein T, Ell C. Computed virtual chromoendoscopy for classification of small colorectal lesions: a prospective comparative study. Am J Gastroenterol 2008; 103: 562-9.
- Ell C, Rabenstein T. Conventional and virtual colonoscopy. Der Internist. 2003; 44: 294-7, 299-301.
- Rabenstein T, Krauss N, Hahn EG, Konturek P. Wireless capsule endoscopy - beyond the frontiers of flexible gastrointestinal endoscopy. Med Sci Monit. 2002; 8: RA128-32.